博康海洋生物
药品检验
联系方式
湛江博康海洋生物有限公司
地址:湛江市麻章区瑞云南路188号
邮编:524094
电话:0759-2732298
电话:0759-2732299
邮箱:bokanghy@163.com
应用研究
关于鲎试剂与细菌内毒素检查法标准化及检查结果的确认
Date: 2018-10-20 09:58:36
莫水晶
(湛江博康海洋生物有限公司,湛江524094)
为做好注射类药品的细菌内毒素检查,提高药品质量和降低生产过程不必要的成本费用,是我们制药工业领域广大工作同仁共同努力的目的。因此,谨以总结我们在这一领域从业30年来认识到的相关问题,提供给读者,其可行性,供参考!
一、鲎试剂研制与鲎试验概述:
在20世纪60年代(1964~1968年),美国科学家J.levin和F.Bang发表鲎血细胞溶解物可被微量细菌内毒素激活形成凝胶反应的论述,并建立细菌内毒素的鲎试验检测方法学。之后,在美国、日本和中国相继开展对美洲鲎和东方鲎血细胞溶解物的提取分离技术研究,到1975年~1986年成功制备出鲎试剂,被官方确认为一种生物活性高的检测试剂。1982年,美国药典USPXX第二增补本正式收载、规定放射性药品和7种大型注射剂使用鲎试验法为合法方法,卫生部于1988年将鲎试验法作为试行标准,用作0.9%氯化钠;5%、10%葡萄糖注射液和注射用水的细菌内毒素检查初试。欧洲药典1987年、日本药局方1988年、英国药典1989年和中国药典1995年版相继收载和规定单个品种的注射药品适用鲎试验法替代“热原检查”项,成为法定方法。
因鲎试验法操作简便、标准化程度高,美国FDA于1987年颁布的《人用、兽用药品、生物制品和医疗器械的细菌内毒素试验指南》和1991年修订的《人用、兽用药品、生物制品内毒素试验的暂行规定》中,除对单个品种进行收载外,同时在方法学上也对定量的比浊法和比色法作了详细的介绍和规定。在USPXXⅢ版和JP13改正版细菌内毒素检查法及第三次国际调和案JIS1992规定的生物学制剂标准,也分别把凝胶法、比浊法和比色法进行了收载。
在世界医、药学卫生领域,鲎试剂的研究成功为细菌内毒素试验方法的确立,与重新制定注射药品安全、有效的质量标准和监控规范中,发挥不可或缺的重要作用。
回顾历史,湛江博康海洋生物有限公司从东方鲎血细胞提取的C因子、凝固酶原研制生产的鲎试剂(TAL)产品,于1988年被国家卫生部作为部颁试行标准用作细菌内毒素检查,与美国研制生产的美洲鲎试剂(LAL)产品,在美国药典XX版(1982年)第二增补本正式收载的细菌内毒素检查鲎试验法,前后仅6年时间,从方法学上接轨。之后,又经历二十多年的研究和发展,目前美国和中国生产供应的鲎试剂标准和使用方法已完全达成了一致。并在2001年1月《BET的国际调和案》中明确了重要的修正条文是:“细菌内毒素检查(凝胶法、光度测定法)的鲎试验,是指从东方鲎和美洲鲎的阿米巴细胞中提取制备的鲎试剂(TAL或LAL);当供试品对鲎试验存在干扰时,应经过适当处理(如经适当处理的鲎试剂对葡聚糖类物质不反应,或对样品调和PH、稀释或其它提取方法)消除干扰后,做本项试验。”
湛江博康海洋生物有限公司,研制生产的特异性鲎试剂,通过光密度曲线和反应速率在同一反应时间内鉴别样品中的“细菌内毒素”与“β-D葡聚糖”的符合率为99.9%。该成果优于美国同类产品技术。
二、各国鲎试剂标准
当前,在全球主要由美国、中国和日本生产鲎试剂(TAL、LAL),该产品,是从美洲鲎或东方鲎血细胞提取溶解物,经冷冻干燥的生物试剂。其产品标准如下表所示:
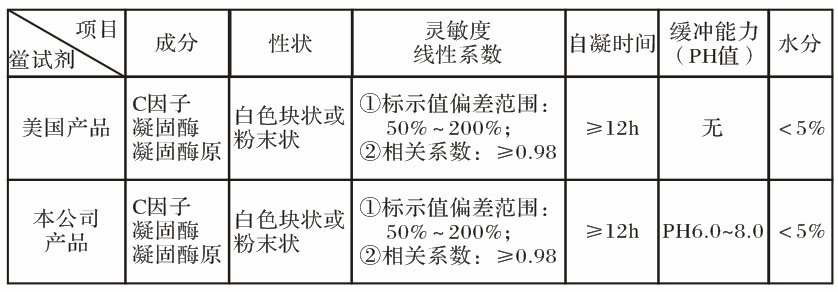
★特别提示:世界各国鲎试剂质量标准规定,鲎试剂冻干品应为白色块状或粉末。不是片状,有的鲎试剂生产供应商在生产工艺中加入过量的聚乙二醇或聚乙烯醇等赋形剂,使鲎试剂成片状,不作为标准要求。因这种高分子物质与药品混合,可能对鲎试剂的凝胶反应过程形成“假阴性”的干扰 。
本公司生产的鲎试剂产品,经检验各项技术指标与美国同类产品一致。自1997年以来,本公司鲎试剂,在中华人民共和国各口岸药品检验所使用,期检查标准与国外药品标准一致,用作进、出口药品的检查,符合法律效力。取代了进口的鲎试剂产品,节约了大量成本费用。
三、世界各国药典规定细菌内毒素检查确定了统一标准,是以EU/ml为标示单位。
细菌内毒素检查法,已是全球通用的基本法。特别是在2001年1月《BET的国际调和案》正式生效后,世界各国药典(如美国药典、欧洲药典、日本药局方和中国药典)已达成统一的细菌内毒素检查(凝胶法、光度测定法)鲎试验法。所有相关的BET试验,如细菌内毒素标准品(RSE)的用途、鲎试剂灵敏度复核、供试品溶液的制备、试验器皿的要求等,在各国药典附录的BET试验条文中都统一了SOP修正内容。
综上情况,明确了中、美、日三国生产的鲎试剂质量等效。在开展药品注射剂、生物制品、放射性药品的细菌内毒素检查时,选用各国药典细菌内毒素标准品(RSE),复核鲎试剂(TAL/LAL)灵敏度,并按药典指南进行操作,其试验结果如下表所示有效。
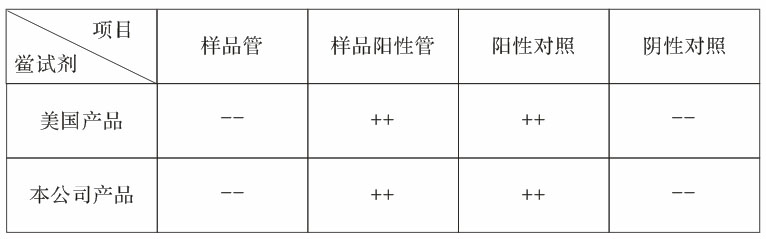
世界各国药典,实施的细菌内毒素检查法,所使用的细菌内毒素参考品(RSE),是统一采用EC-6为基准物进行标定的。因此,各国鲎试剂灵敏度的标定、标准是统一的。按上表各项试验管对照目的成立,是好的验证方法,细菌内毒素检查鲎试验法,在2001年1月《BET国际调和案》中已明确了美洲鲎试剂(LAL)和东方鲎试剂(TAL)质量等效、合法。
建议您选用本公司生产的鲎试剂产品,我们将提供优良的产品和尽善尽美的技术服务!
(本文完)
作者联系电话:0759-2732288


